Rezatapopt es un fármaco en fase de investigación que no ha sido aprobado por la FDA estadounidense, la EMA ni ninguna otra autoridad sanitaria.
Objetivos del estudio
El objetivo del estudio PYNNACLE es evaluar la seguridad, tolerabilidad, farmacocinética, farmacodinámica y eficacia del rezatapopt en pacientes con tumores sólidos que presentan una mutación TP53 Y220C, que incluye, entre otros, el cáncer de ovario, cáncer de pulmón, cáncer de mama y cáncer de endometrio.
PYNNACLE es un estudio clínico de Fase 1/2
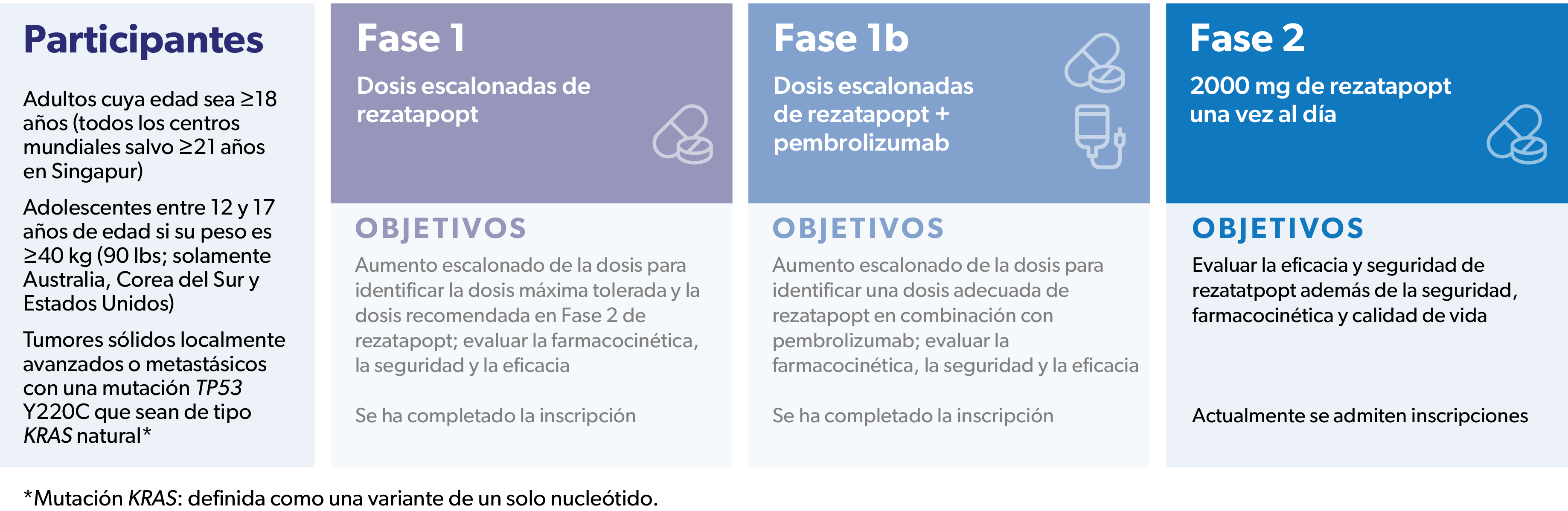
PYNNACLE (NCT04585750) es un estudio clínico multicéntrico de Fase I/II, abierto y en curso, de rezatapopt (solo y en combinación con pembrolizumab), en pacientes con tumores sólidos localmente avanzados o metastásicos que presenten una mutación TP53 Y220C.
Rezatapopt es el primer reactivador selectivo de p53 por vía oral de su clase específico para TP53 Y220C.
Los objetivos de la Fase 1 de este estudio eran hallar una dosis adecuada del rezatapopt y evaluar la farmacocinética, la seguridad y la eficacia. Se ha completado la inscripción en la Fase 1 del tratamiento en Monoterapia.
El objetivo de la Fase 1b del estudio era evaluar el rezatapopt en combinación con el pembrolizumab. Se ha completado la inscripción en la Fase 1b del Tratamiento Combinado.
Los objetivos de la Fase 2 del estudio son evaluar la eficacia del rezatapopt por sí solo, así como la seguridad, la farmacocinética y la calidad de vida. Actualmente, se admiten inscripciones en esta fase del estudio.
Criterios de elegibilidad de pacientes
Los siguientes criterios de idoneidad son aplicables a la Fase 2 del estudio. Para obtener más información sobre los criterios de idoneidad, visite clinicaltrials.gov.
Criterios de inclusión:
Pacientes que presenten tumores sólidos localmente avanzados o metastásicos con una mutación TP53 Y220C
Adultos cuya edad sea ≥18 años (todos los centros mundiales salvo ≥21 años en Singapur)
Adolescentes entre 12 y 17 años de edad si su peso es ≥40 kg (90 lbs; solamente Australia, Corea del Sur y Estados Unidos)
Tratados anteriormente con uno o más esquemas de tratamiento anticanceroso
Puntuación del estado funcional del Eastern Cooperative Oncology Group* de 0 o 1
Criterios de exclusión:
Metástasis cerebral, salvo que se haya estabilizado neurológicamente
Antecedentes de enfermedad leptomeníngea, compresión de la médula espinal, trasplante de órganos o enfermedad gastrointestinal que pueda afectar la absorción del fármaco en estudio
Tumor primario del sistema nervioso central
Afecciones cardíacas, como angina inestable, hipertensión no controlada, infarto de miocardio en los 6 meses anteriores al cribado, insuficiencia cardíaca y anomalías del ritmo cardíaco
Conocido como mutación KRAS, que se define como variante de un solo nucleótido
*La puntuación del estado funcional del Eastern Cooperative Oncology Group mide la capacidad de las personas para desenvolverse y cuidar de sí mismas.1
Referencia: 1. VeryWellHealth. ¿Qué es el estado funcional? Consultado en enero de 2024.
Ubicaciones del estudio clínico PYNNACLE
PYNNACLE está reclutando pacientes con tumores sólidos que presentan la mutación TP53 Y220C en centros médicos de todo el mundo.
Información adicional sobre estudios clínicos
Averigüe más sobre estudios clínicos en el National Cancer Institute, la American Cancer Society, y la Agencia Europea de Medicamentos.
Para saber más sobre rezatapopt (también denominado PC14586) en el estudio PYNNACLE, visite clinicaltrials.gov.
Rezatapopt es un fármaco en fase de investigación que no ha sido aprobado por la FDA estadounidense, la EMA ni ninguna otra autoridad sanitaria para el tratamiento del cáncer.
Las imágenes no representan a los participantes reales en el ensayo.
MA-586-0035 Octubre 2024
