Objectifs de l’étude
Cette étude PYNNACLE vise à évaluer l'innocuité, la tolérance, la pharmacocinétique, la pharmacodynamie et l'efficacité du rezatapopt chez les patients atteints de tumeurs solides présentant une mutation TP53 Y220C, y compris, mais sans s'y limiter, le cancer de l'ovaire, le cancer du poumon, le cancer du sein et le cancer de l'endomètre.
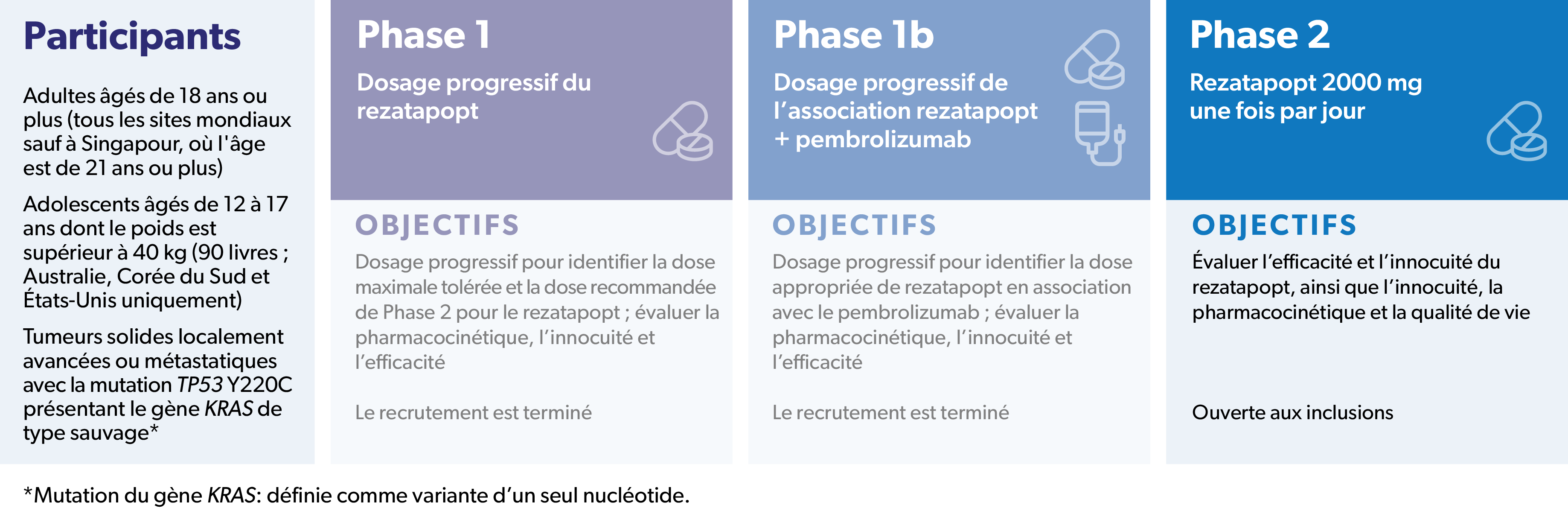
PYNNACLE est une étude clinique de Phase 1/2
PYNNACLE (NCT04585750) est une étude clinique de Phase 1/2 ouverte et multicentrique en cours visant à évaluer le rezatapopt (seul ou en association avec le pembrolizumab) chez les patients atteints de tumeurs solides localement avancées ou métastatiques présentant une mutation TP53 Y220C.
Le rezatapopt est le premier réactivateur sélectif de la protéine p53 administré par voie orale, spécifique de la mutation TP53 Y220C.
Les objectifs de la Phase 1 de cette étude consistaient à déterminer une dose appropriée de rezatapopt, ainsi qu'à évaluer la pharmacocinétique, l'innocuité et l'efficacité de ce produit. Le recrutement pour la Phase 1 (Monothérapie) est terminé.
L'objectif de la Phase 1b de l'étude est d'évaluer le rezatapopt en association avec le pembrolizumab. Le recrutement pour la Phase 1b (Thérapie Combinée) est terminé.
Les objectifs de la Phase 2 de l'étude sont d'évaluer l'efficacité du rezatapopt en monothérapie, ainsi que l'innocuité et la pharmacocinétique du produit, et enfin la qualité de vie qu'il apporte. Cette partie de l’étude est actuellement ouverte aux inclusions.
Critères d’éligibilité des patients
Les critères d'éligibilité suivants s'appliquent à la Phase 2 de l'étude. Pour plus d'informations sur les critères d'éligibilité, veuillez consulter le site clinicaltrials.gov.
Critères d’inclusion:
Patients atteints d’une tumeur solide localement avancée ou métastatique présentant une mutation TP53 Y220C
Adultes âgés de 18 ans ou plus (tous les sites mondiaux sauf à Singapour, où l'âge est de 21 ans ou plus)
Adolescents âgés de 12 à 17 ans dont le poids est supérieur à 40 kg (90 livres ; Australie, Corée du Sud et États-Unis uniquement)
Précédemment traités avec une ou plusieurs lignes de traitement anticancéreux
Score de performance ECOG (Eastern Cooperative Oncology Group) de 0 ou 1
Critères d’exclusion:
Métastases cérébrales, sauf si elles sont neurologiquement stables
Antécédents d’atteinte leptoméningée, de compression de la moelle épinière, de greffe d’organe ou de maladie gastro-intestinale pouvant avoir un impact sur l’absorption du médicament à l’étude
Tumeur primaire du système nerveux central
Affections cardiaques, telles qu’angor instable, hypertension non contrôlée, crise cardiaque dans les 6 mois précédant la sélection des patients pour l’étude, insuffisance cardiaque et anomalies du rythme
Mutation connue du gène KRAS, définie comme variante d’un seul nucléotide
Sites de l’étude clinique PYNNACLE
PYNNACLE recrute actuellement des patients atteints de tumeurs solides présentant une mutation TP53 Y220C dans des centres médicaux du monde entier.
Plus d’informations sur les études cliniques
Votre patient peut en apprendre davantage sur les études cliniques menées par le National Cancer Institute, l’American Cancer Society et l’Agence européenne des médicaments.
Pour en savoir plus sur le rezatapopt (également connu sous le nom de PC14586) dans l’étude PYNNACLE, veuillez vous rendre sur le site clinicaltrials.gov
Veuillez contacter le Centre d’information sur les études cliniques de PMV Pharmaceutical
+1 (609) 235-4038
clinicaltrials@pmvpharma.com
Le rezatapopt est un traitement expérimental qui n’a pas été homologué par la FDA (Food and Drug Administration) américaine, l’Agence européenne des médicaments (EMA), ou toute autre agence de réglementation pour le traitement du cancer.
Les images ne représentent pas les participants à l'essai.
MA-586-0035 Octobre 2024
